医薬品 開発 流れ

医薬品 Ii新薬の研究開発 承認のプロセス
医薬品開発に関係する市場のまとめ Venture Hack
1万種類もの化合物を合成する新薬開発 データ管理が開発効率化の決め手に Monoist

富士フイルム 記録紙総合サイト Club Gc
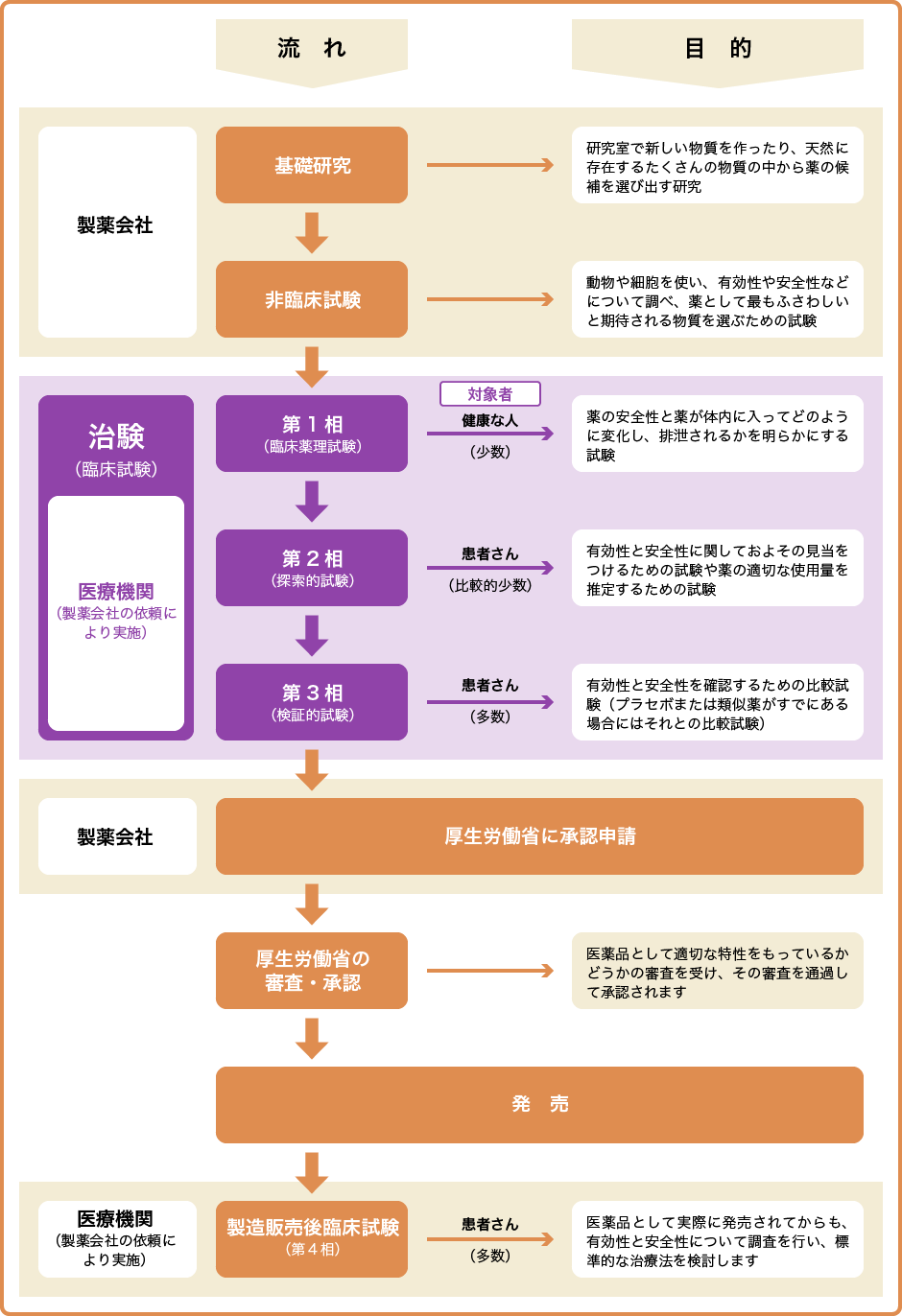
治験の実施プロセスとインフォームドコンセント
くすりができるまで 採用サイト エイツーヘルスケア株式会社
医薬品開発の一般的な流れ プラントの温度、圧力、近赤外スペクトル(nir)などの観測が容易な変数(X) から観測が困難な製品物性、濃度など(y)をリアルタイムに予測・評価 (ソフトセンサー:統計モデル) 医薬品としての高い品質を満たしながら.
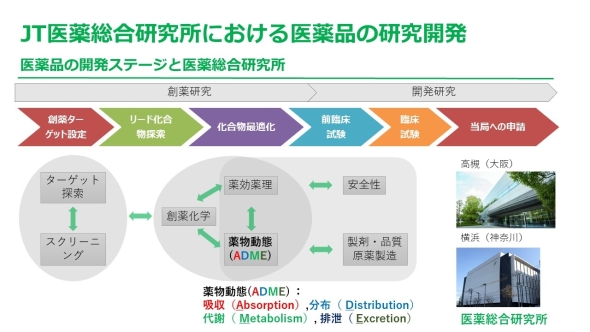
医薬品 開発 流れ. > 医薬品の創り方と開発から販売までの流れ > 医薬品の臨床試験(治験)の流れ 新薬の開発と言えども人への実験で未確認の物質を試すことなど絶対にあってはならないことです。. バイオ医薬品の開発には、従来の低分子化合物の開発に比べ、より広範で高度な技術が必要。 ・・・バイオ医薬品でも低分子化合物でも必要な技術 ・・・バイオ医薬品に必要となる技術 ・・・低分子医薬品に必要となる技術. 研究開発(創薬研究)の流れ 創薬研究とは文字通り、薬を創り出す研究で、「探索研究」「開発研究」「臨床研究」の3段階からなります。 探索研究は、創薬プロセスの上流に位置し、有用性の高い新規化合物の探索・創出をはじめ、最新技術による創薬研究へのアプローチや社外リソースを活用した基礎研究も行っています。 探索研究により創出された候補化合物.
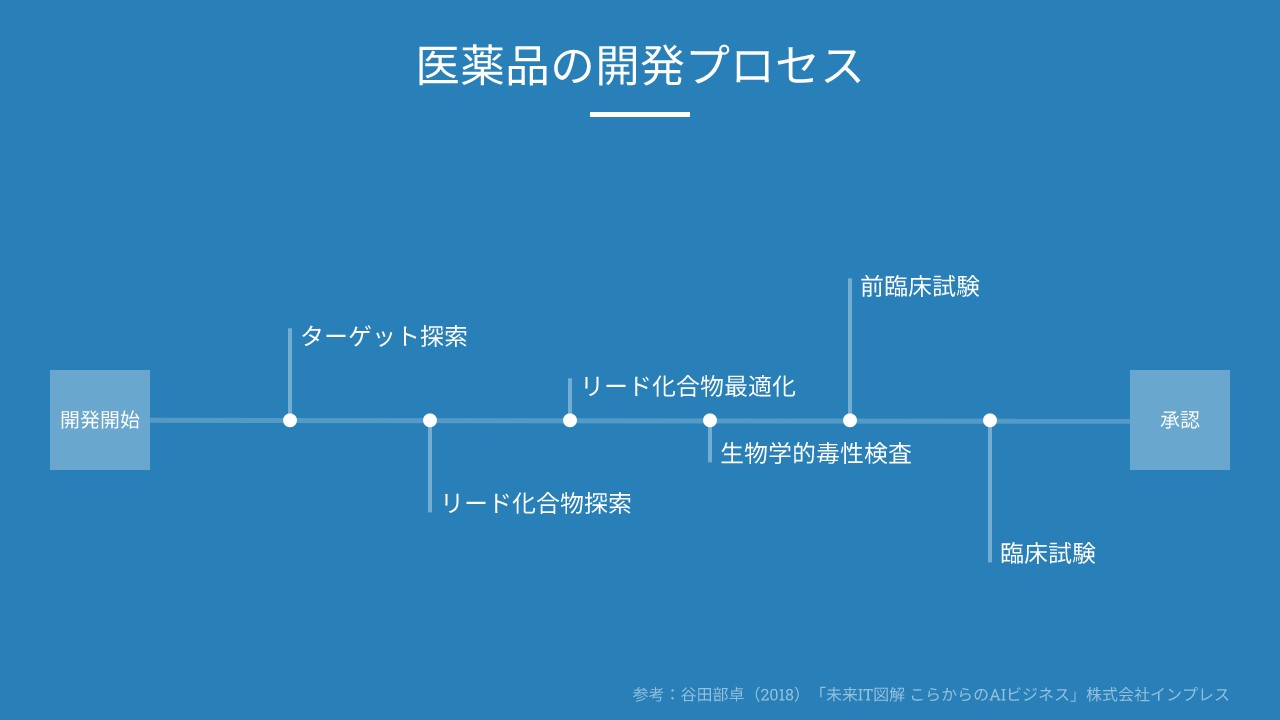
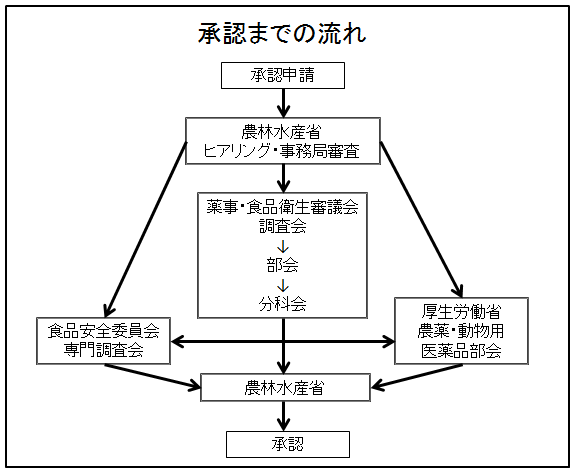
化合物を合成、培養、抽出などにより広範に収集し、数十万から数百万の化合物群からなるライブラリーを作成する。 ゲノム、プロテオーム解析などを通じて、病態にかかわると考えられる標的分子を見つけだす。 まず、ライブラリーの中から、ハイスループット・スクリーニングなどの手法を用いて、新薬のもととなるリード化合物を見つけだす。 さらに. 医薬品産業(いやくひんさんぎょう、英 pharmaceutical industry )とは、認可医薬品を創薬、開発、生産、市場販売する一連の産業をさす 。 医薬品産業には、法的規制や特許権、広告宣伝規制など、様々な法的権利が関わってくる。 とくに製薬(せいやく)とは、医薬品を製造することである。. 1234 医薬品の開発プロセスとPMDA 図2 新医薬品の承認審査の流れ GMP:good manufacturing practice,医薬品等の製造管理および品質管理に関する基準 基礎研究など 前臨床 治験 申請 審査 承認 保険 適用 1 相談業務*2 PMDAの業務: 3 安全対策 PMDAの業務: 2 審査業務.
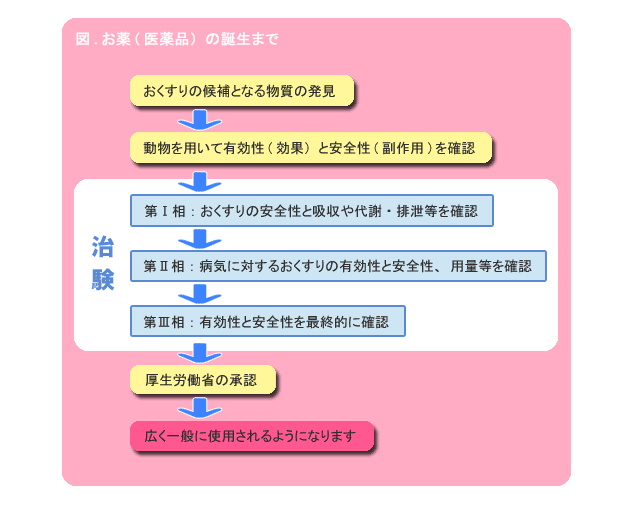
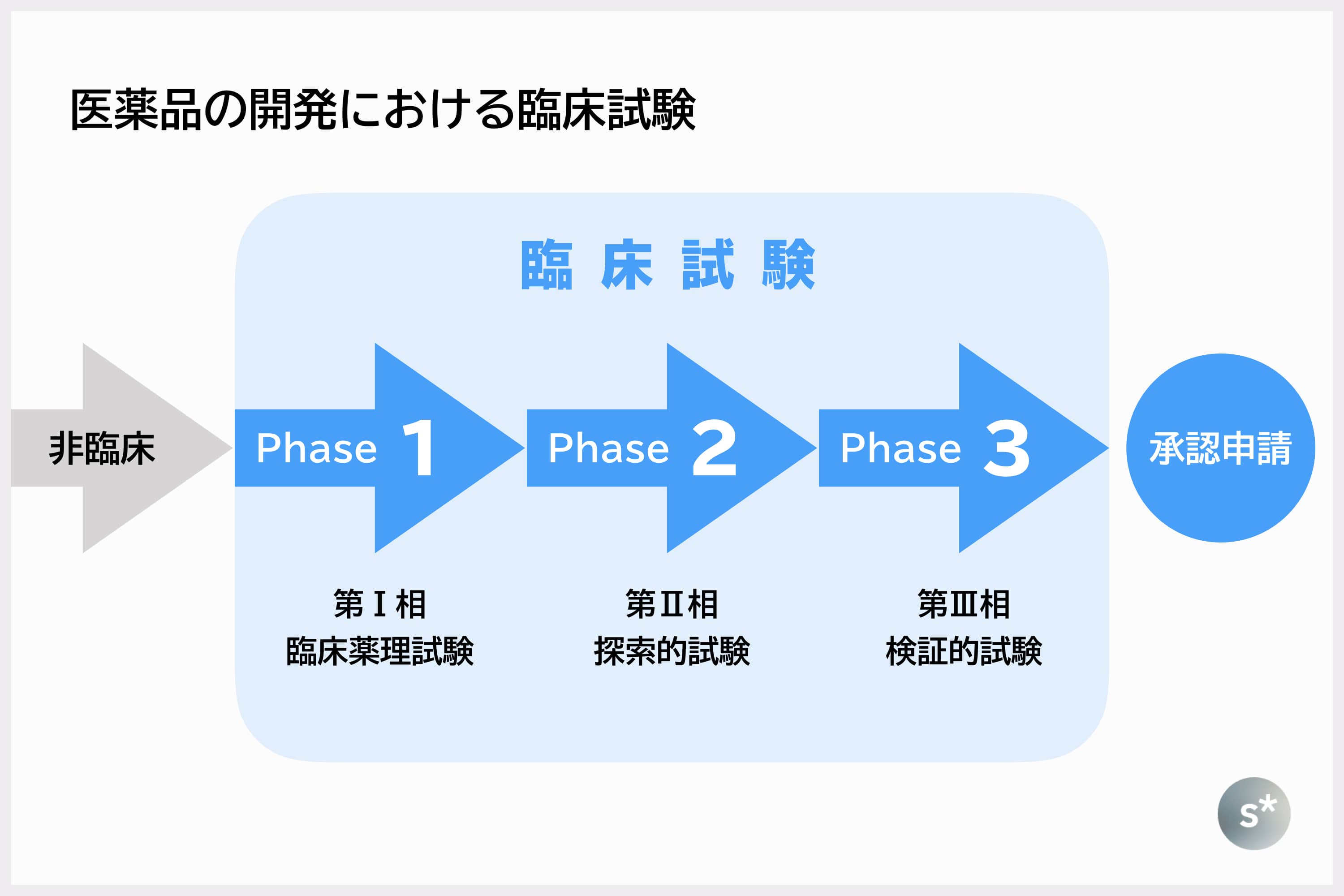
新薬開発の道のり・臨床試験(治験)の流れ 新しい薬を創るためには様々な試験を行い、有効性や安全性を評価する必要があります。 臨床試験(治験)とは、基礎研究、非臨床試験などの研究過程を経て、薬の候補が実際に人に役立つかどうかを確認する試験のことです。 臨床試験は、通常3つのステップに分けられ、厳しい基準に従って、病院などの医療機関に. 創薬にもいろいろな手法がありますが、現在主流となっている「合成創薬」の大まかな流れを述べれば、 (1)標的タンパク質の決定 (2)シード化合物の発見 (3)スクリーニングによる改良 (4)最終的候補化合物の選定 ━━ということになります。 こうして選び出された化合物が、人体での臨床試験というステージ へ駒を進めます。 よく「研究開発」と一口. 医薬品産業の現状と課題 主な現状と課題 Ⅰ我が国は数少ないグローバルな医薬品開発の拠点の一角を占めている Ⅱ医薬品開発の費用は高騰する一方、日本企業の規模は小さい Ⅲ多くの大手製薬企業が長期収載品に収益を依存しており、転換が急務.
例えば・・・ ・「医薬品開発」で「構造最適化」を目標としている場合 →「応用」 ・「医療機器開発」で「要素技術開発」を目標としている場合 →「基礎的」 ・「再生医療等製品開発」で「毒性試験」を目標としている場合 →「非臨床試験・前臨床試験」 など. また,医薬品開発の 全体的な流れを学ぶことにより,その後の各章で学ぶ内 容が開発過程のどの部分に位置づけられるのかを理解す る。あわせて,近年,その必要性が高まっているレギュ ラトリーサイエンスの意義についても学ぶ。 本章の構成 11 医薬品. ―医薬品開発においても今後は、データサイエンスが勝負のカギを握るわけですか。 板倉 :その流れは間違いないでしょう。 こうしたトレンドに対応するため、社会人を対象としたデータサイエンスのリカレント教育を行う大学が出てきています。.
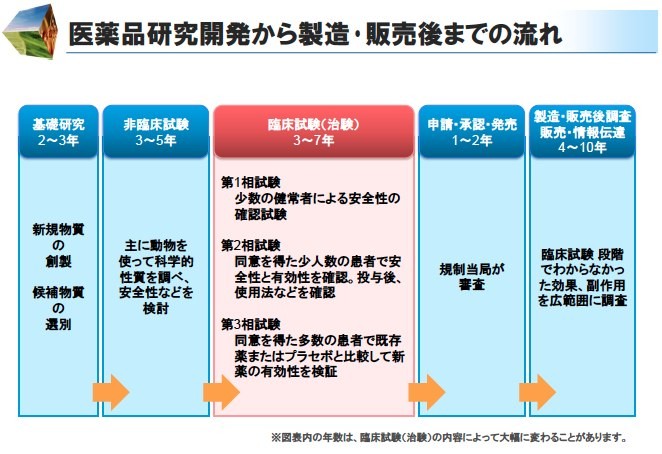
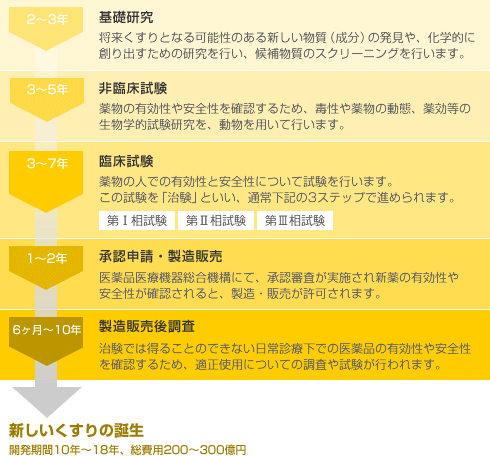
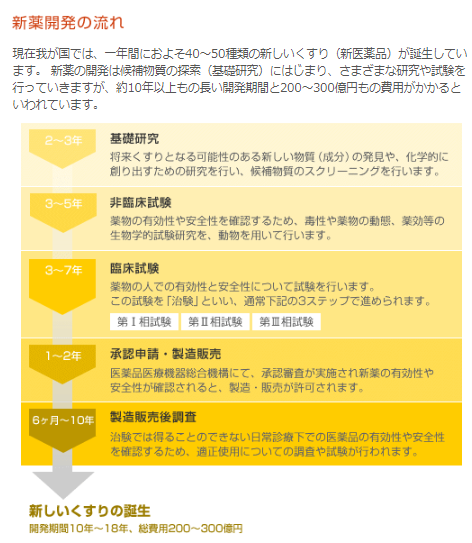
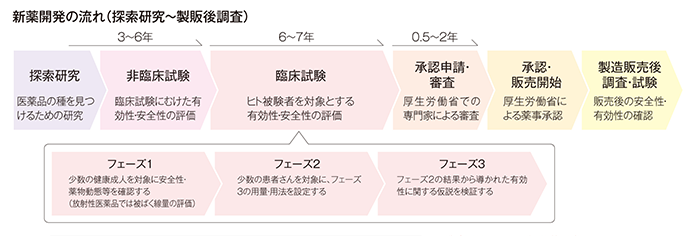
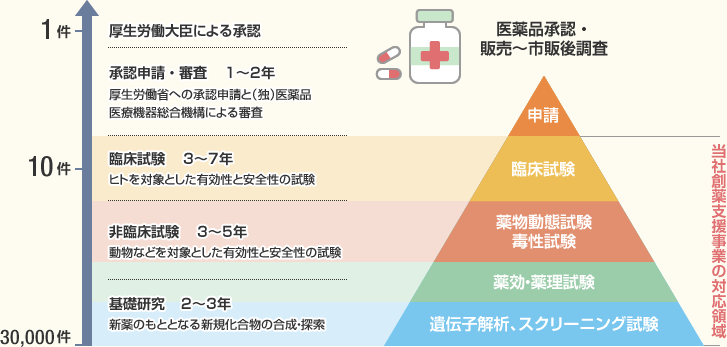
び、新医薬品の製造販売の承認を受けようとするときは、その品 質、有効性及び安全性を裏づけるための試験成績に関する資 料を提出しなければならない(法第14条第3項)。 11 新医薬品の開発 新医薬品の開発においては、承認審査のための資料作りが. 開発 物理・化学的 現象の探索 ピボタル 試験 探索的 臨床試験 大分類 医薬品開発 (流れは低分子の例) 基礎研究 応用研究 開発研究 疾病の本態解明等理論・知識の探求 具体的目標(疾患治療等)のもと実用化や応用に向けた研究 前臨床 開発 基礎研究. 医薬品の開発の基本的な流れ 医薬品のモトとなる新規物質の合成・発見 新規物質の有効性と安全性の研究(動物が対象) ヒトを対象とした 有効性と安全性 のテスト 企業から厚生労働省への承認申請と (独)医薬品医療機器総合機構による審査 厚生労働省による薬価の設定と薬価基準収載 発売後の安全性や使用法のチェック 基礎研究 2~3年 非臨床試験 3~5年.
医薬品メーカー 薬の候補となる新規物質の創製と研究・開発を行う(2~3年)。 また、非臨床試験(3~5年)を行い、製剤し、治験届けを出す。 医薬品は治験後、承認許可申請が行われ、国の審査(1~2年)を通った後、市場に出る。. 参考:医薬品の開発の流れ 基礎研究 応用研究(少なくとも10年以上を要する) 産業応用 (実用化) 病気の 本態解明 ヒット 化合物 創薬標的 タンパク質 リード 化合物 医薬品 候補 医薬品 製薬企業と共同研究 (ライセンスアウト) ターゲットタンパク研究. 医薬品産業(いやくひんさんぎょう、英 pharmaceutical industry )とは、認可医薬品を創薬、開発、生産、市場販売する一連の産業をさす 。 医薬品産業には、法的規制や特許権、広告宣伝規制など、様々な法的権利が関わってくる。 とくに製薬(せいやく)とは、医薬品を製造することである。.
参考:医薬品の開発の流れ 基礎研究 応用研究(少なくとも10年以上を要する) 産業応用 (実用化) 病気の 本態解明 ヒット 化合物 創薬標的 タンパク質 リード 化合物 医薬品 候補 医薬品 製薬企業と共同研究 (ライセンスアウト) ターゲットタンパク研究. 医薬品開発の一般的な流れ プラントの温度、圧力、近赤外スペクトル(nir)などの観測が容易な変数(X) から観測が困難な製品物性、濃度など(y)をリアルタイムに予測・評価 (ソフトセンサー:統計モデル) 医薬品としての高い品質を満たしながら. 医薬品等の副作用・感染に よる健康被害の救済 医薬品・医療機器の 安全対策 医薬品・医療機器の 承認審査 医療費、障害年金、遺族一時金等の支給 特定c型肝炎患者被害者への給付金の支給 治験相談・申請前相談・簡易相談 情報の提供、医薬品・医療機器.
医薬品の研究開発 ~くすりができるまで~ 新薬は、通常10年以上の年月をかけて、基礎研究・非臨床試験・臨床試験(治験)の過程を経て有効性、安全性、および品質が検討されます。 その後、審査を経たうえで日本では厚生労働大臣の承認を得て初めて患者さんに処方できる医薬品が誕生します。 新薬が誕生するまでのプロセスは、およそ以下のように進みます。. バイオ医薬品の開発には、従来の低分子化合物の開発に比べ、より広範で高度な技術が必要。 ・・・バイオ医薬品でも低分子化合物でも必要な技術 ・・・バイオ医薬品に必要となる技術 ・・・低分子医薬品に必要となる技術. 医薬品産業(いやくひんさんぎょう、英 pharmaceutical industry )とは、認可医薬品を創薬、開発、生産、市場販売する一連の産業をさす 。 医薬品産業には、法的規制や特許権、広告宣伝規制など、様々な法的権利が関わってくる。 とくに製薬(せいやく)とは、医薬品を製造することである。.
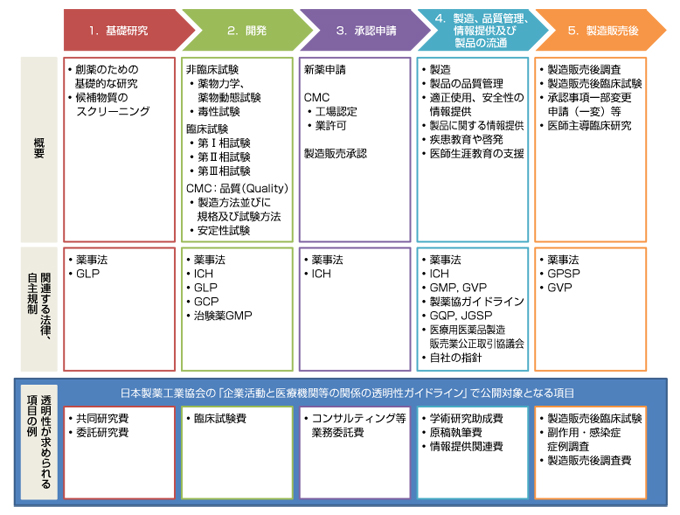
科目名 創薬情報科学(学部3年:分担講義) 内容 医薬品の研究開発とデータの流れ: 医薬品の研究開発の過程と、当該過程における各種試験で得られるデータの流れを解説する。. 医薬品の開発 1 .開発から承認までの過程 すでに製造販売の承認を与えられている医薬品及び日本薬 局方に定められている医薬品と有効成分、用法・用量、効能・ 効果、投与経路等が明らかに異なる医薬品を新医薬品とよ.

体外診断用医薬品 海外製造 薬事申請関連業務支援 事業 サービス紹介 株式会社micメディカル
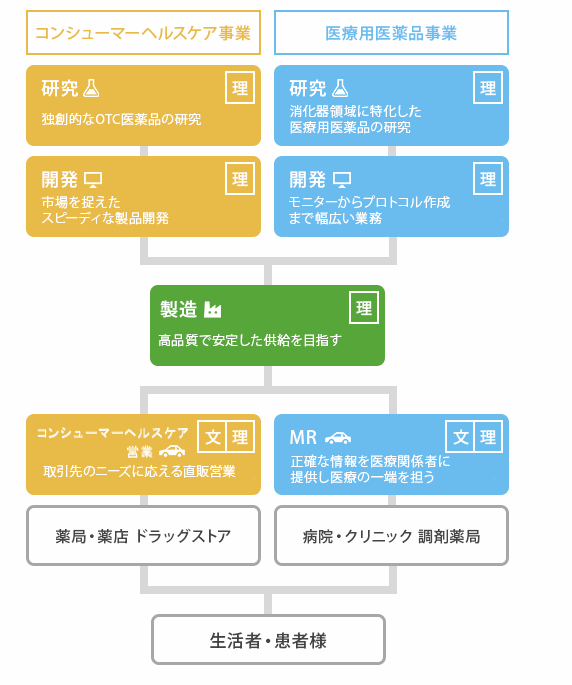
職種相関 採用情報 ゼリア新薬工業
治験に参加するメリットとは まずは治験の仕組みをつかもう Trans To Trans

実験医学 次世代抗体医薬の衝撃 新たな標的 新たな機序によりいま再び盛り上がる抗体創薬
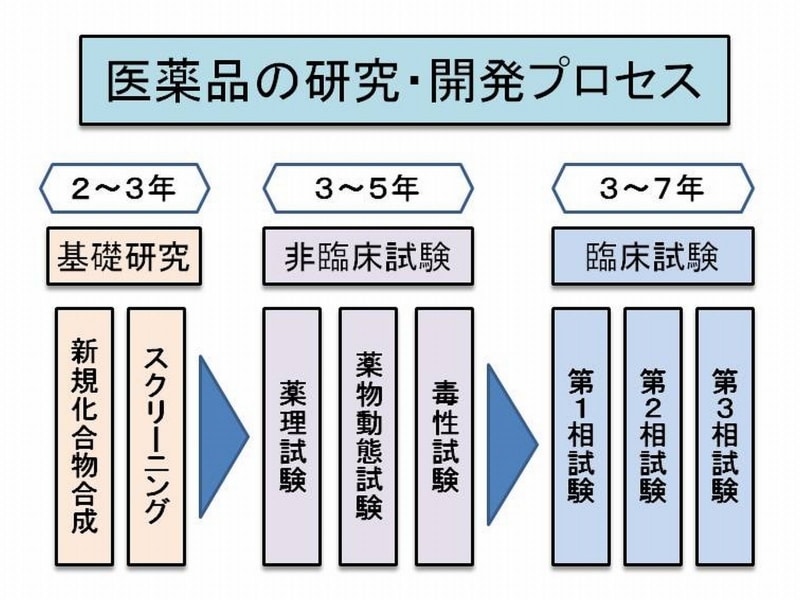
医薬品の研究開発から流通まで 基本と最近の課題 Mrの転職 All About

医療機関の治験実施体制強化を目的とした演者派遣のご案内 治験に関する医薬品評価委員会の成果物 日本製薬工業協会
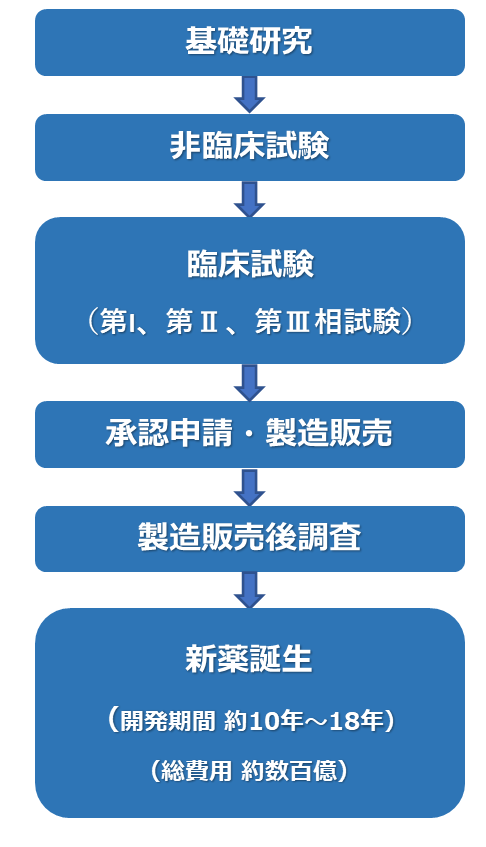
医薬品開発の流れ
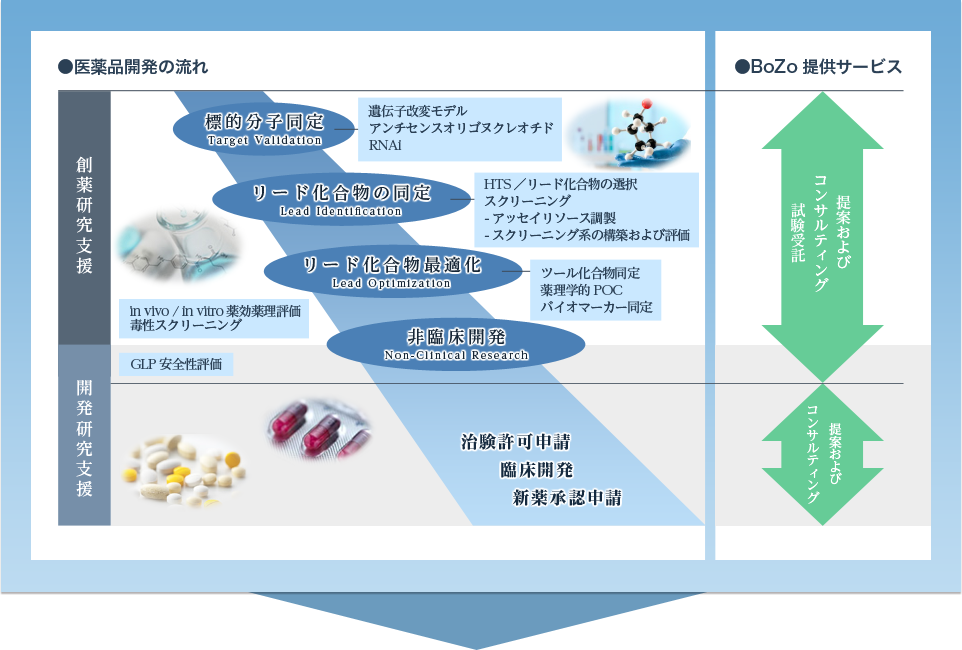
創薬 開発支援のボゾリサーチセンター 抗がん剤 代謝性疾患治療薬を社会へ
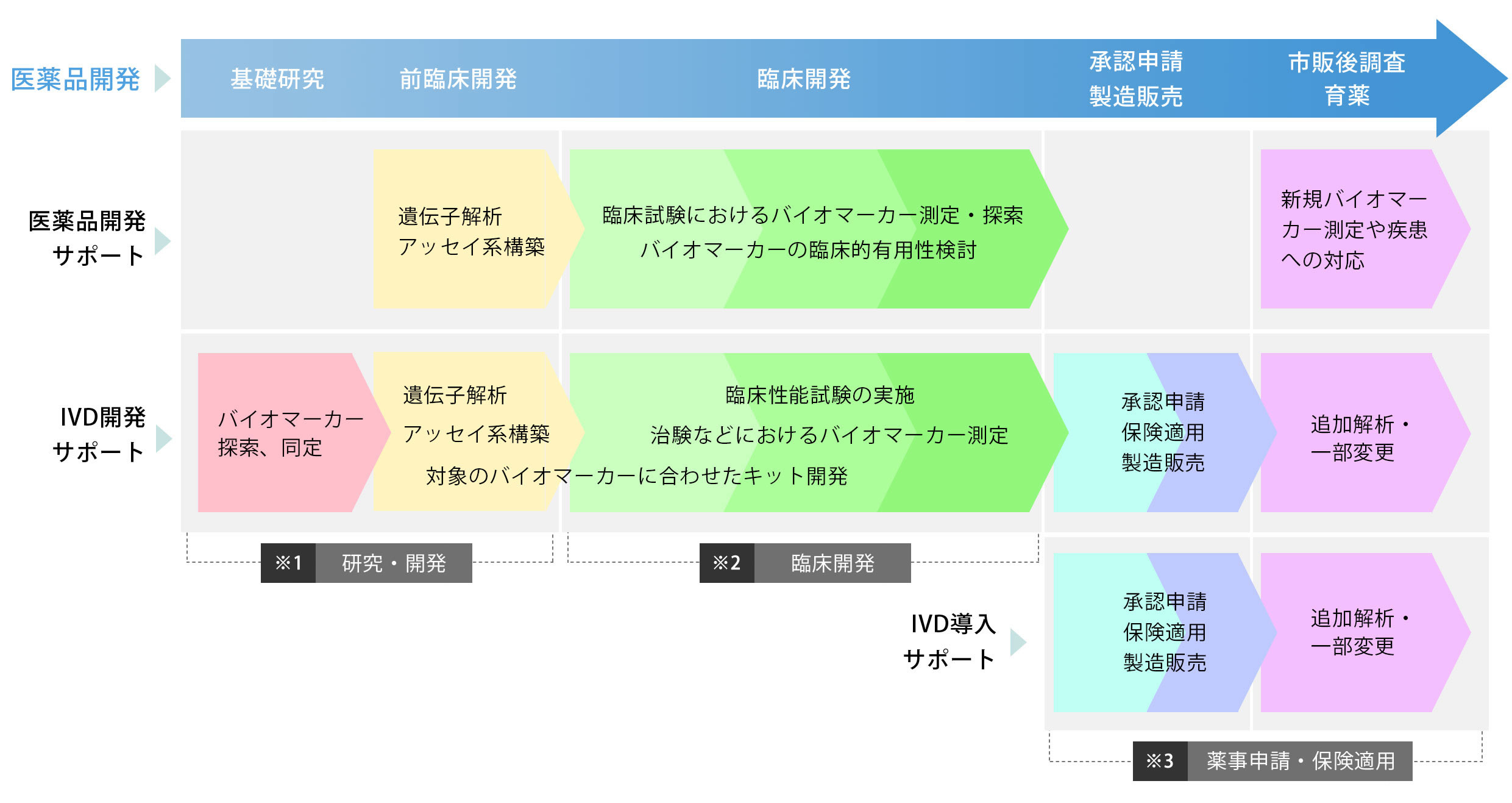
医薬品開発支援

承認審査業務 申請 審査等 独立行政法人 医薬品医療機器総合機構
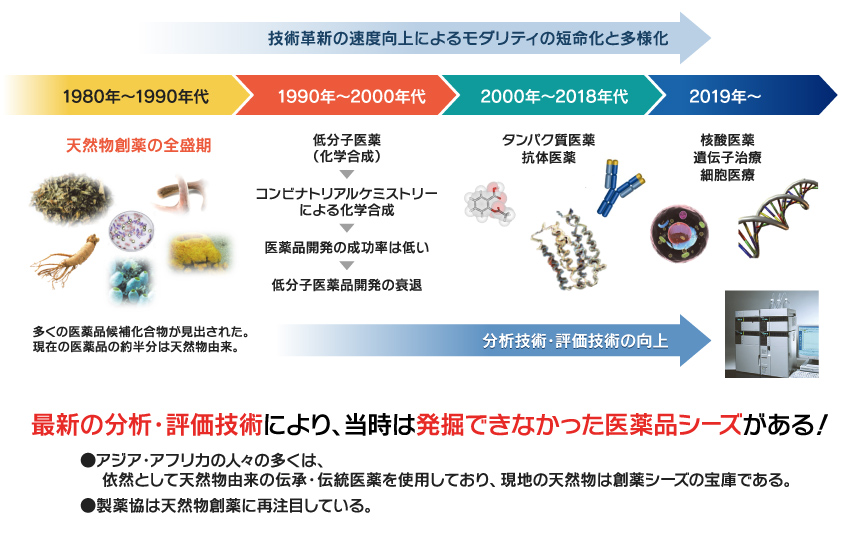
なぜ 今天然物創薬か センター紹介 熊本大学大学院生命科学研究部附属 グローバル天然物科学研究センター

研究開発の流れと出口戦略 研究開発マネジメント部 筑波大学つくば臨床医学研究開発機構 Tsukuba Clinical Research Development Organization

Mr職 研究開発職 生産職 仕事紹介 あすか製薬株式会社 Recruit21

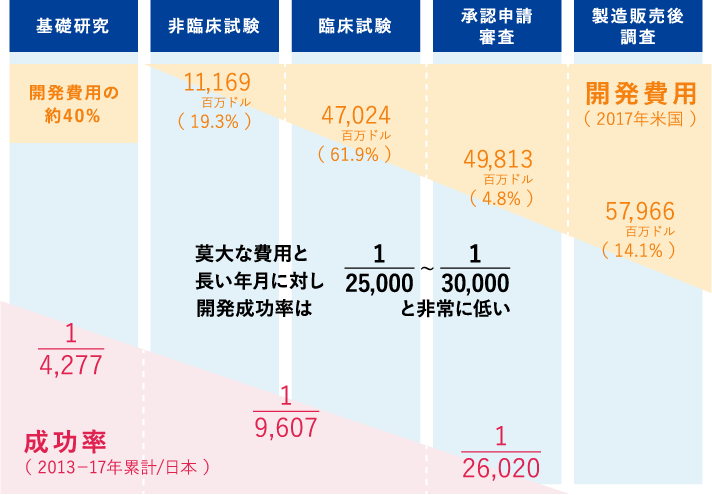
Q33 1つのくすりを開発するのに どれくらいの年月がかかりますか くすりについて 日本製薬工業協会
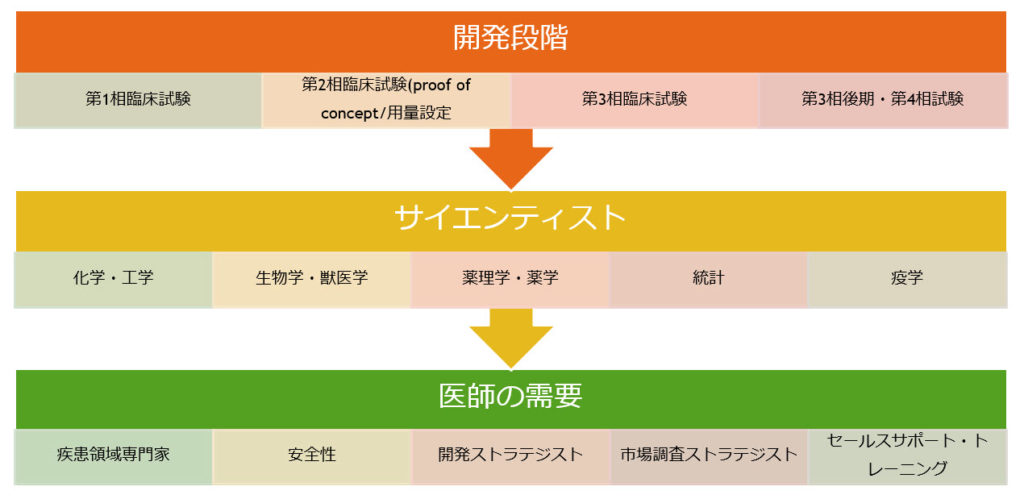
医薬品開発とは Ddcp Official Website
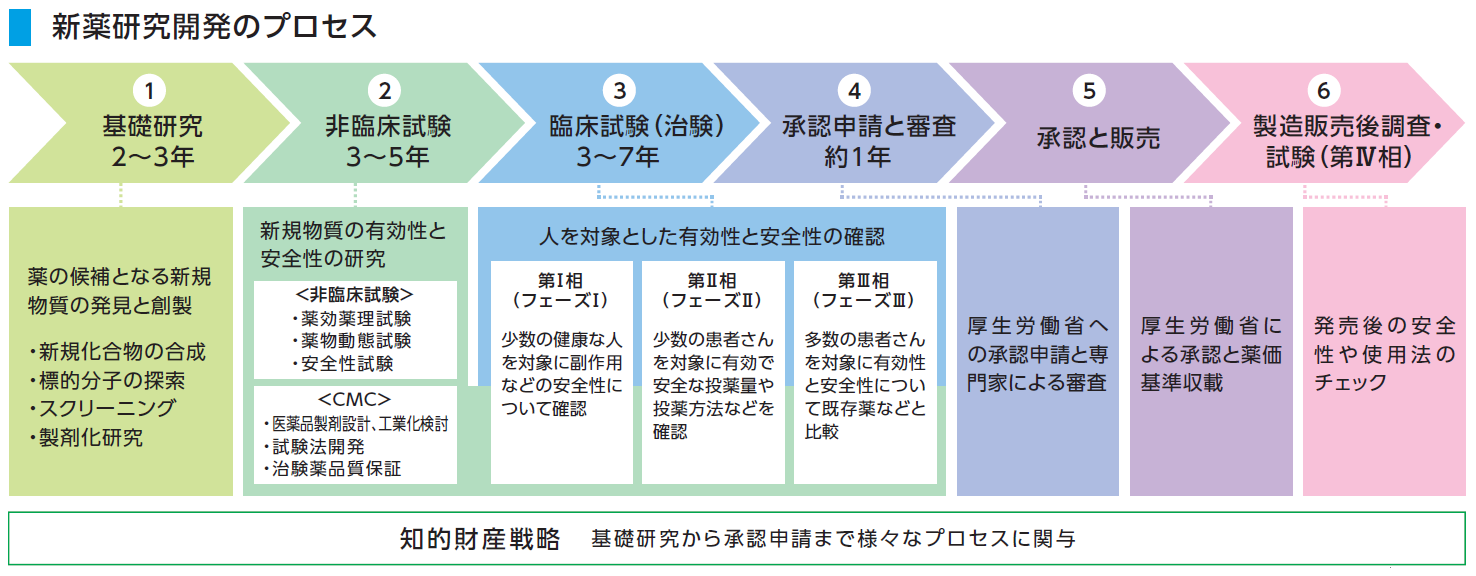
新薬研究開発のプロセス 研究開発 生化学工業株式会社
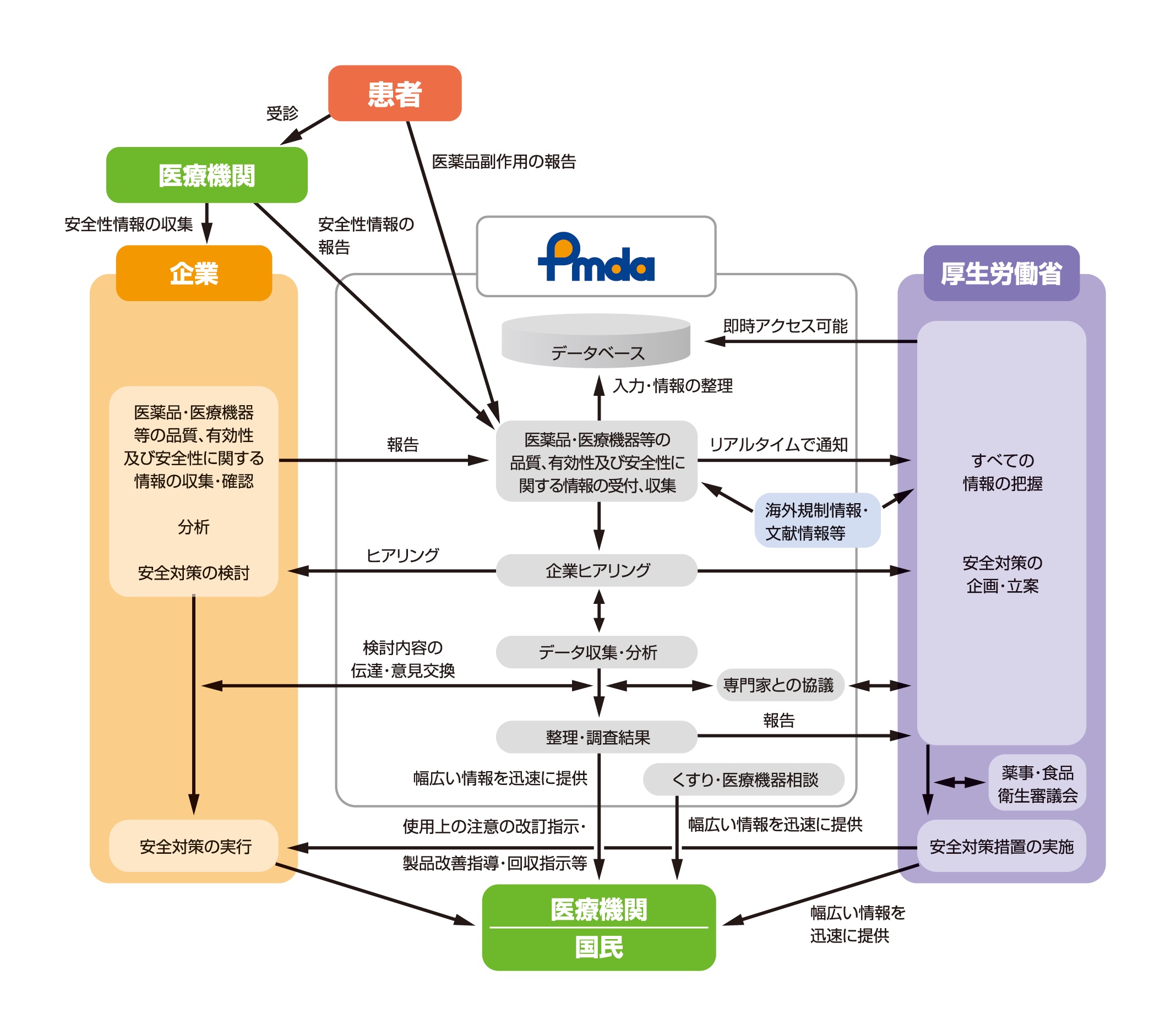
安全対策業務の概要 独立行政法人 医薬品医療機器総合機構

厚労省が運用を開始した医薬品の 条件付き早期承認制度 3つのポイント Answersnews
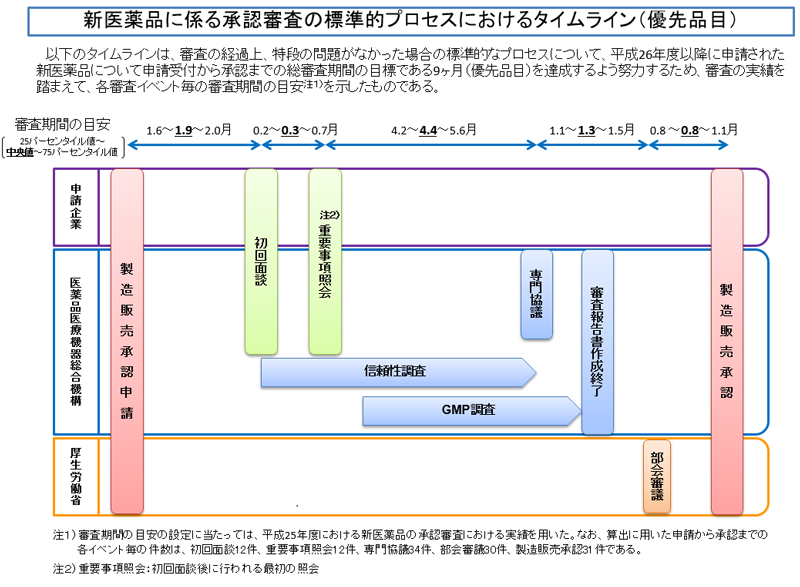
新医薬品に係る承認審査の標準的プロセスにおけるタイムライン 独立行政法人 医薬品医療機器総合機構
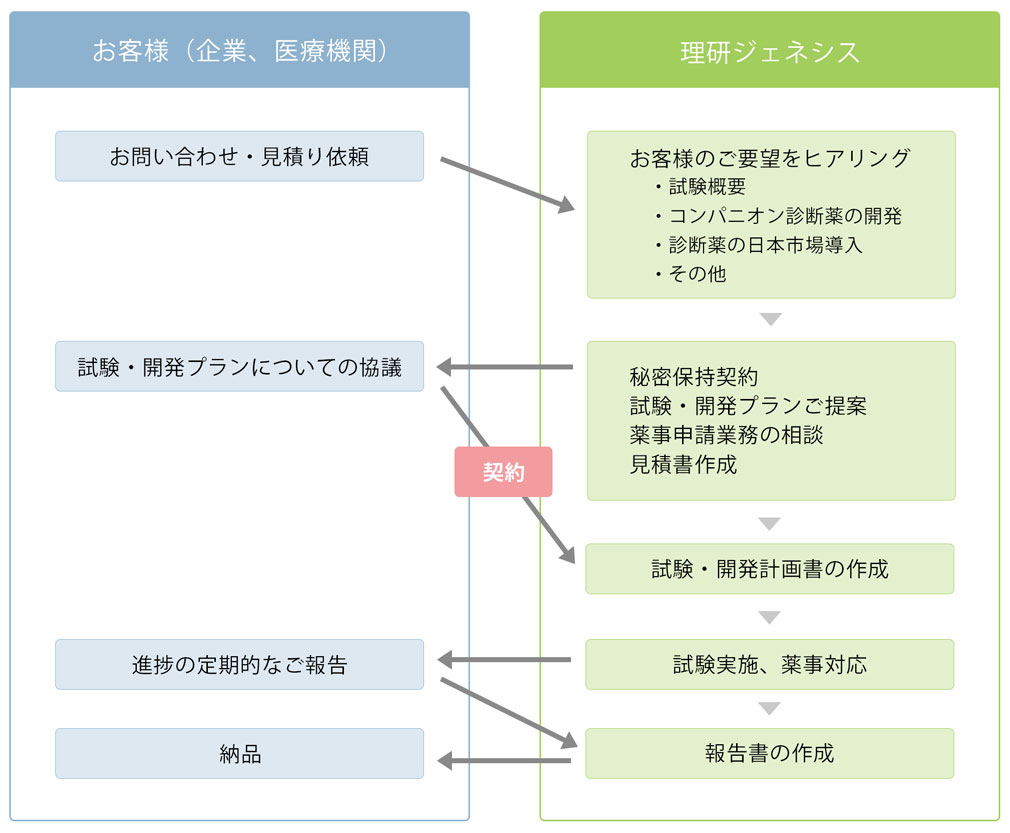
医薬品開発支援

受託サービスの流れ バイオ医薬品安全性試験サービス バイオ医薬品開発支援サービス 遺伝子医療 タカラバイオ株式会社
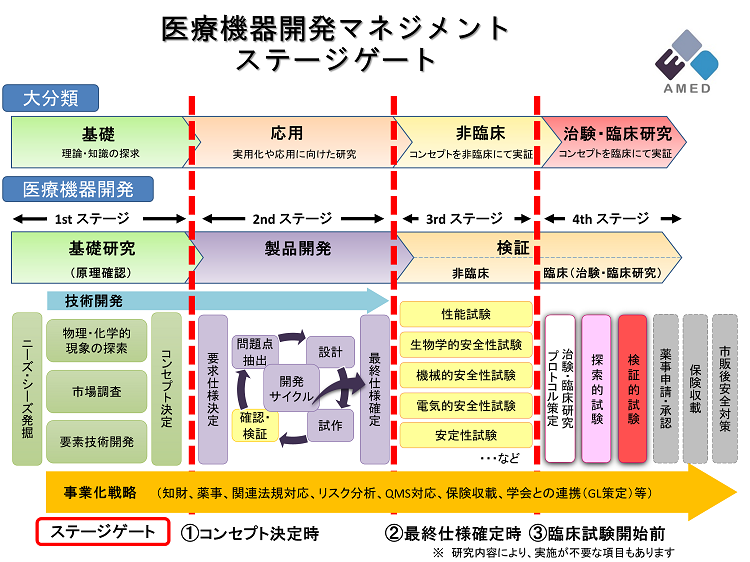
医療機器の研究開発マネジメントにおけるチェックポイント ステージゲート 国立研究開発法人日本医療研究開発機構
抗体に関する研究開発事業 事業内容 次世代バイオ医薬品製造技術研究組合
新薬メーカー業界研究 の解説 バリュートレンド 長期投資家のためのir情報
Q Tbn And9gcrxqbx1e8gxpfdrv6qzbxzsl8h1uolobezj31 54p87ebgg2uv Usqp Cau

医薬品の特許 製薬会社が独占販売できる期間は10年程度

シミックホールディングスの企業研究 製薬業界の転職サイト Answers アンサーズ

ジェネリック医薬品と薬剤師

Cro業界とcraの仕事 株式会社micメディカル

Cro Smoへの就職と業界動向 薬剤師 薬学部生のインターン 就業体験情報ならめでぃしーんねっと22
Q Tbn And9gcrpwitx5wbuvlns0nvzlqeq5hpq 1m2vsn7ldws0ycu5kbk0sd Usqp Cau
Oncology領域のphase1試験について考えてみる 臨床開発 はるきちのブログ

新薬開発について Craの仕事とは 派遣 人材派遣のテンプスタッフ

ジェネリック医薬品って何 一般 患者の皆様へ 光製薬株式会社

マイクロドーズ臨床試験の受託を開始 ニュース 積水メディカル株式会社

研究開発の流れと出口戦略 研究開発マネジメント部 筑波大学つくば臨床医学研究開発機構 Tsukuba Clinical Research Development Organization

研究開発部門 部門紹介 製薬 医薬品 十全化学株式会社の求人情報

医薬品開発事業 クレイス株式会社

日本ジェネリック株式会社 ジェネリック医薬品をもっと良く知っていただくために ジェネリック医薬品は なぜ安いの
Q Tbn And9gcszqzukwqn768supyo8aqqbdc94crqhqkn Edr3xjuhq7mhmu7a Usqp Cau
研究開発取り組み事例 日本メジフィジックス株式会社
創薬支援事業 積水メディカル株式会社 新卒採用サイト
Efpia Japan くすりの一生
ビジネスモデル Sbiバイオテック

北海道臨床開発機構 アカデミアによる医薬品 医療機器等の実用化に至る道すじ

研究開発について 研究開発 デ ウエスタン セラピテクス研究所
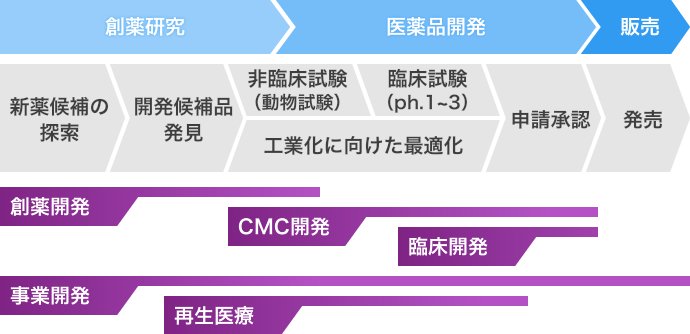
医薬品開発支援について 医薬品開発支援 Obpc 大杉バイオファーマ コンサルティング株式会社
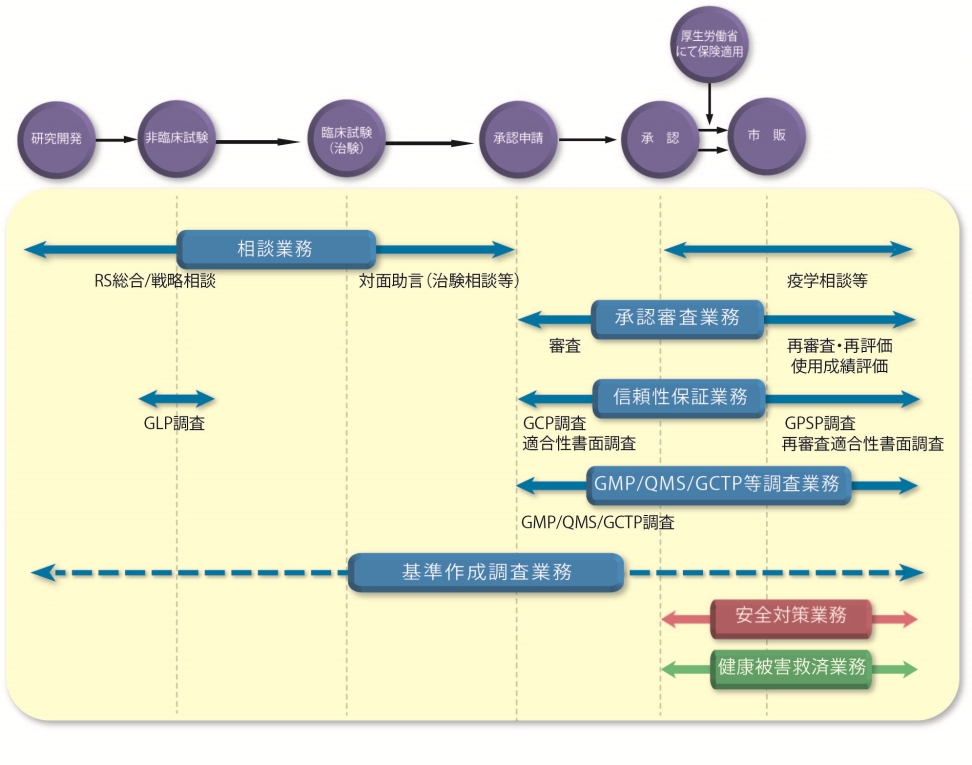
審査関連業務の概要について 独立行政法人 医薬品医療機器総合機構
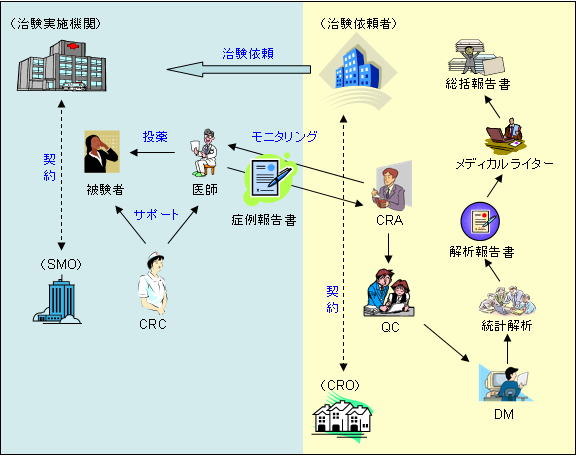
医薬品 医療機器の研究 開発 ポータルサイト 治験 臨床開発 臨床統計 Beagle Hc

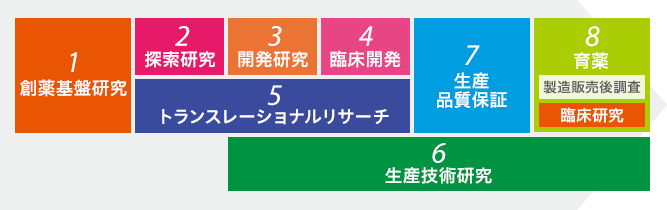
研究開発 創薬研究 の流れ 研究開発 エーザイ株式会社

製造販売承認の流れ 再生医療製品事業 株式会社ジャパン ティッシュ エンジニアリング J Tec

研究開発部門 部門紹介 製薬 医薬品 十全化学株式会社の求人情報

薬理学第4回 1022 医薬品開発の流れ Youtube
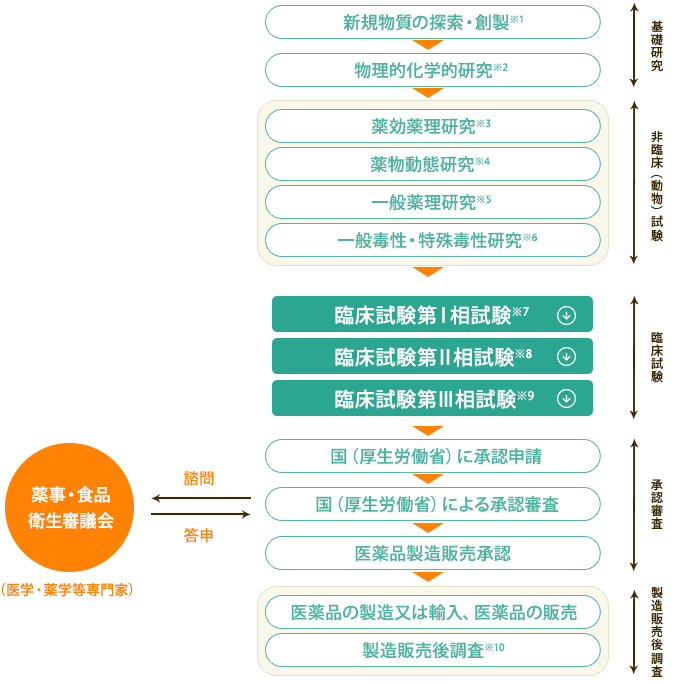
治験の3つのステップ 一般の方へ 群馬大学医学部附属病院 臨床試験部
臨床研究 治験とは 一般の方へ 臨床研究管理センター Center For Clinical Research 富山大学附属病院

医薬品メーカーへの就職と業界動向 薬剤師 薬学部生の新卒採用 就職 求人情報ならめでぃしーんねっと21
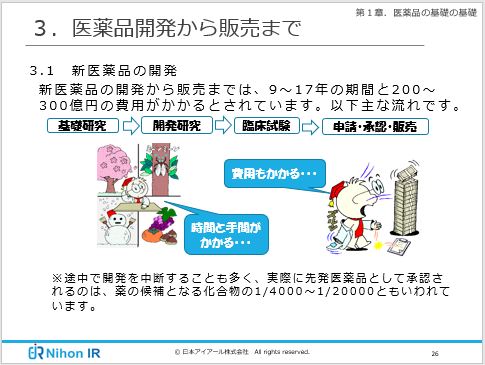
医薬品業界の基礎知識 Eラーニング アイアール技術者教育研究所 製造業エンジニア 研究開発者のための研修 教育ソリューション

医薬品情報学 研究室紹介 研究 慶應義塾大学 薬学部 薬学研究科
Www Mhlw Go Jp Shingi 10 04 Dl S0421 4c 0002 Pdf

ニューライフ タイムズ ジェネリック医薬品の謎
3
Aiは創薬の課題を解決できるのか Aiが創薬に及ぼす影響 Ai専門ニュースメディア Ainow

事業について 株式会社リニカル
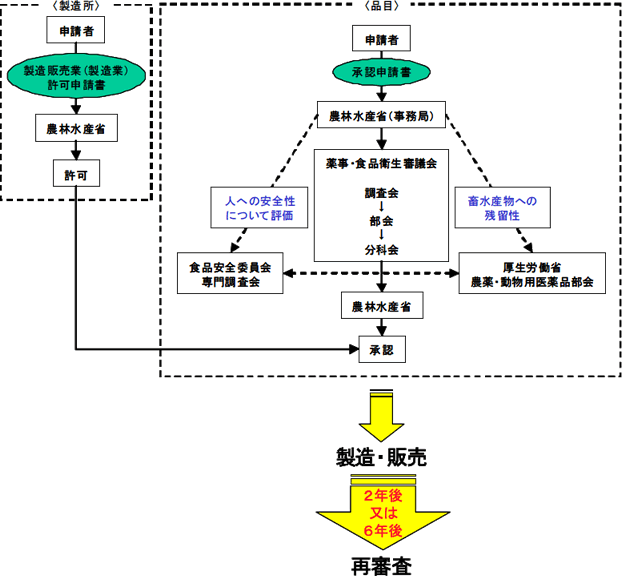
開発の流れ 公益社団法人日本動物用医薬品協会
ドラッグラグ 医薬品開発における2つの ラグ を解説 Starnote

開発振興部 医薬基盤 健康 栄養研究所国立研究開発法人 医薬基盤 健康 栄養研究所

信頼性保証業務 Glp Gcp Gpsp 独立行政法人 医薬品医療機器総合機構
ヒアリング 調査会 指摘への対応のポイント
研究開発について 研究開発 協和キリン

受託の流れ 医薬品受託製造 医薬品受託開発 受託製造は富士フイルム和光純薬株式会社

Covid 19のワクチンと治療薬はいつできる Di Online
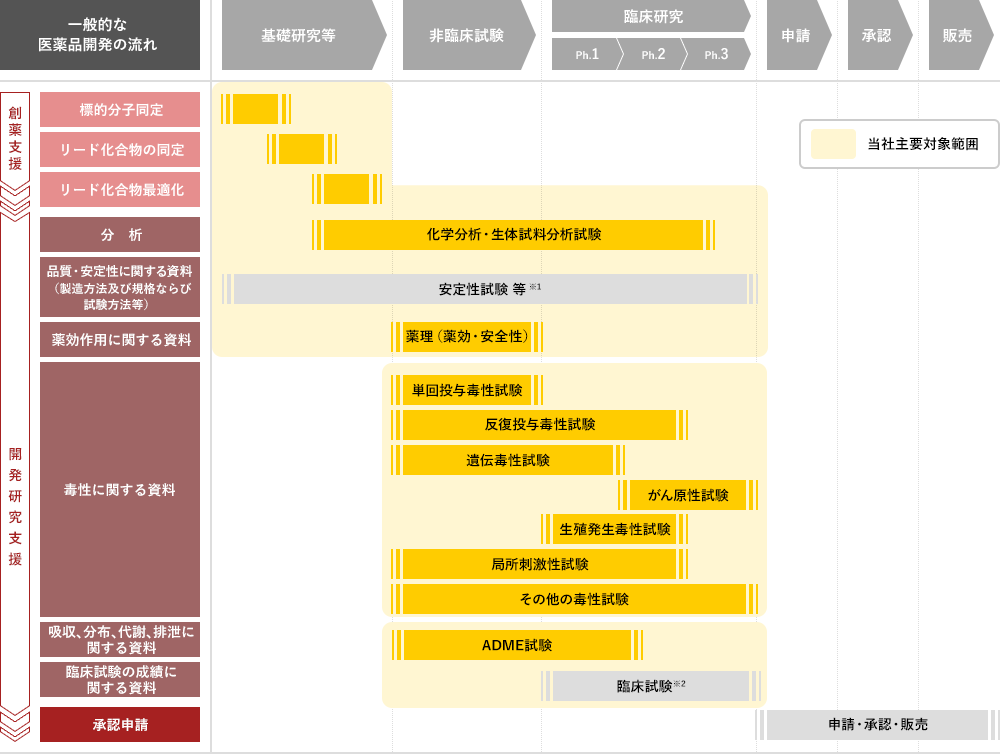
医薬品 安全性試験 毒性試験の受託機関 ボゾリサーチセンター

製造販売承認の流れ 再生医療製品事業 株式会社ジャパン ティッシュ エンジニアリング J Tec
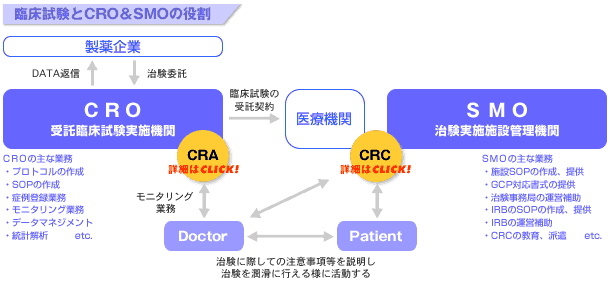
業界情報 Cro Smoとは 製薬専門の転職紹介 求人案内なら株式会社メディサーチ
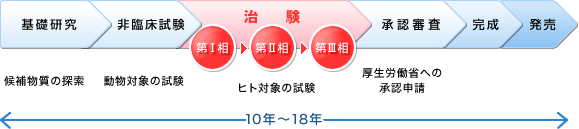
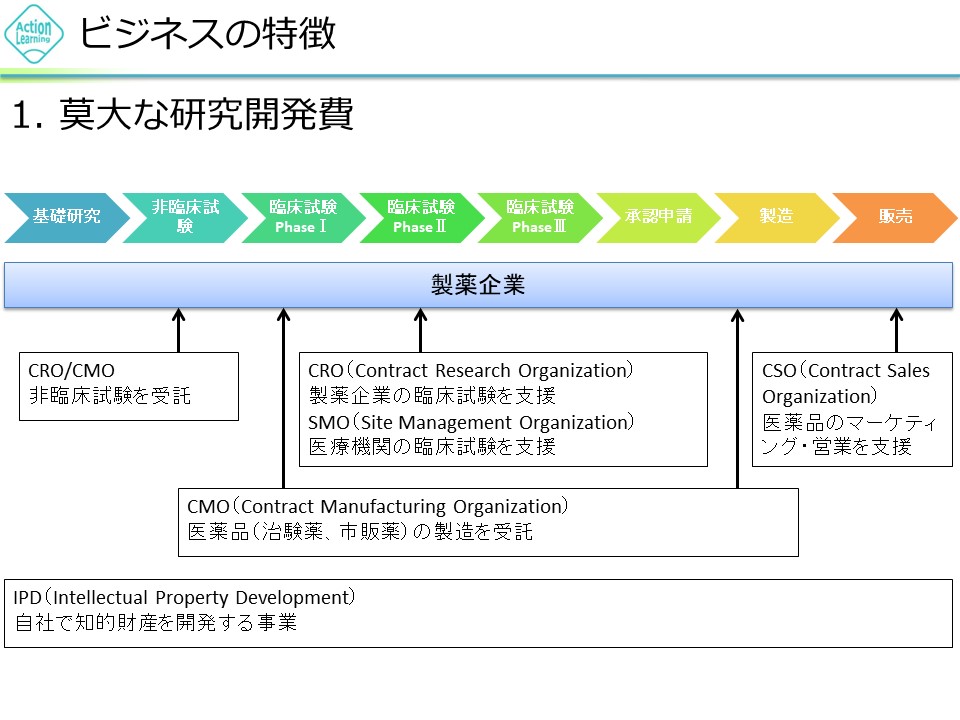
製薬企業における新薬開発の流れ 莫大な研究開発費と期間が必要です
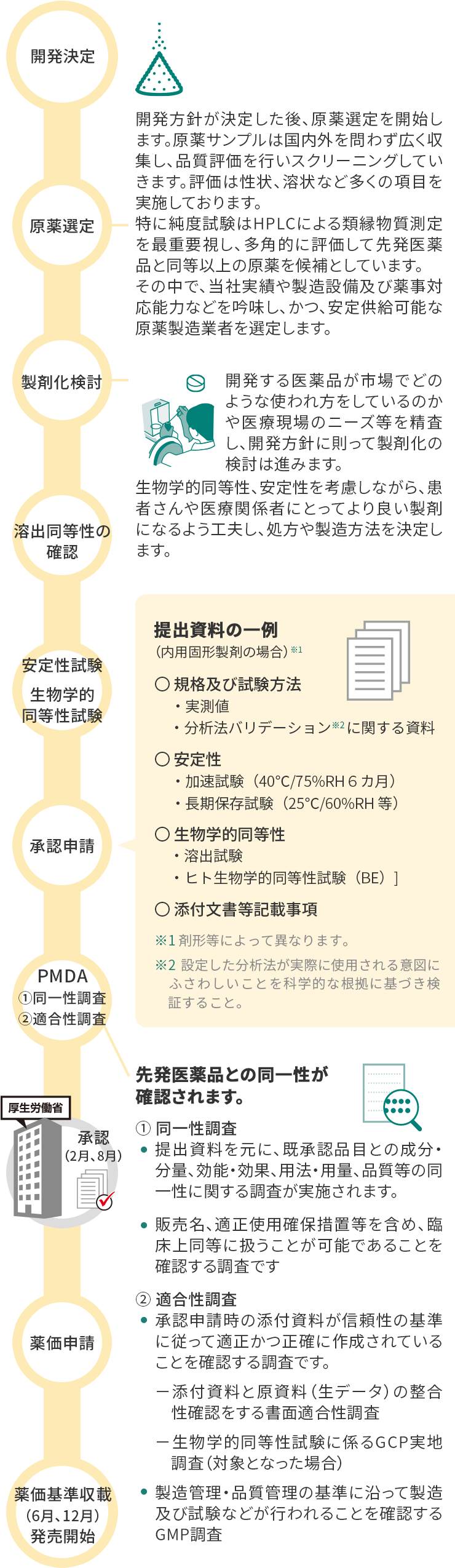
サワイジェネリック 開発への取り組み 沢井製薬

Mr職 研究開発職 生産職 仕事紹介 あすか製薬株式会社 Recruit21
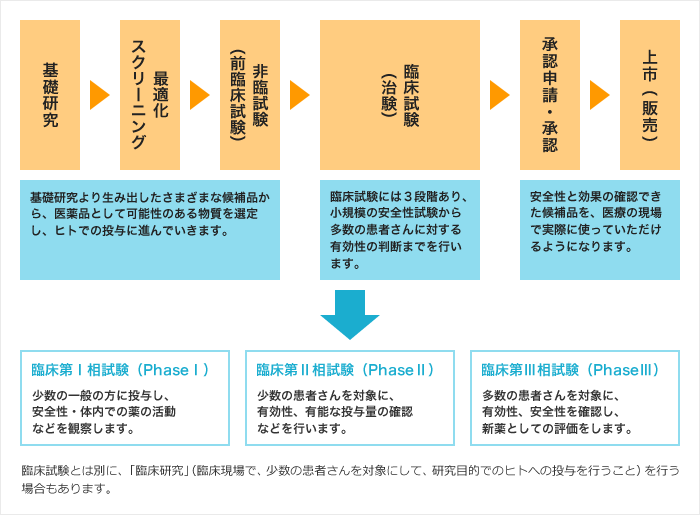
研究開発パイプライン Sbiバイオテック
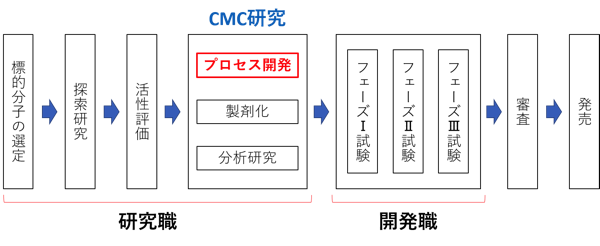
医薬品原薬のプロセス開発の研究職に中途採用で転職する求人とは 研究開発職ジョブ 理系の研究職 開発職の転職 求人情報

進化を続ける製薬業界とcroの存在意義 イーピーエス株式会社採用情報

Mgcファーマ株式会社 バイオ医薬開発受託サービス
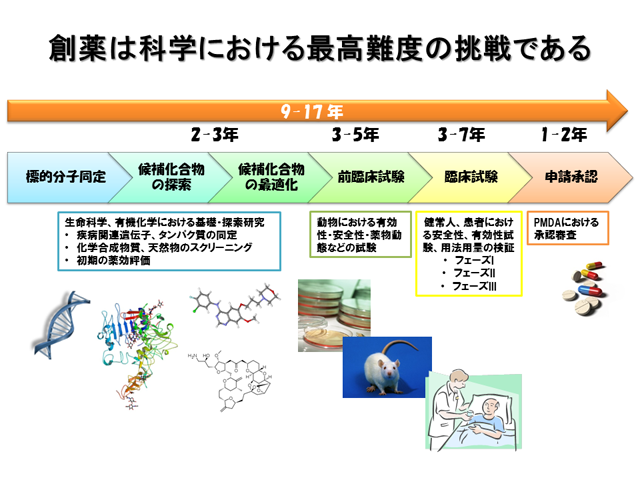
創薬 って何 達人に訊け 中日新聞web
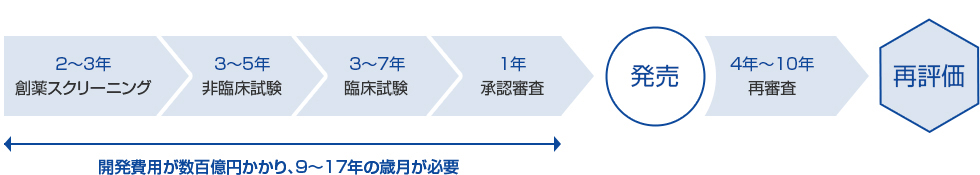
開発体制 日医工株式会社

研究開発の流れと出口戦略 研究開発マネジメント部 筑波大学つくば臨床医学研究開発機構 Tsukuba Clinical Research Development Organization

創薬 探索臨床研究コアセンター トランスレーショナルリサーチ部門 東北大学大学院医学系研究科附属 創生応用医学研究センター
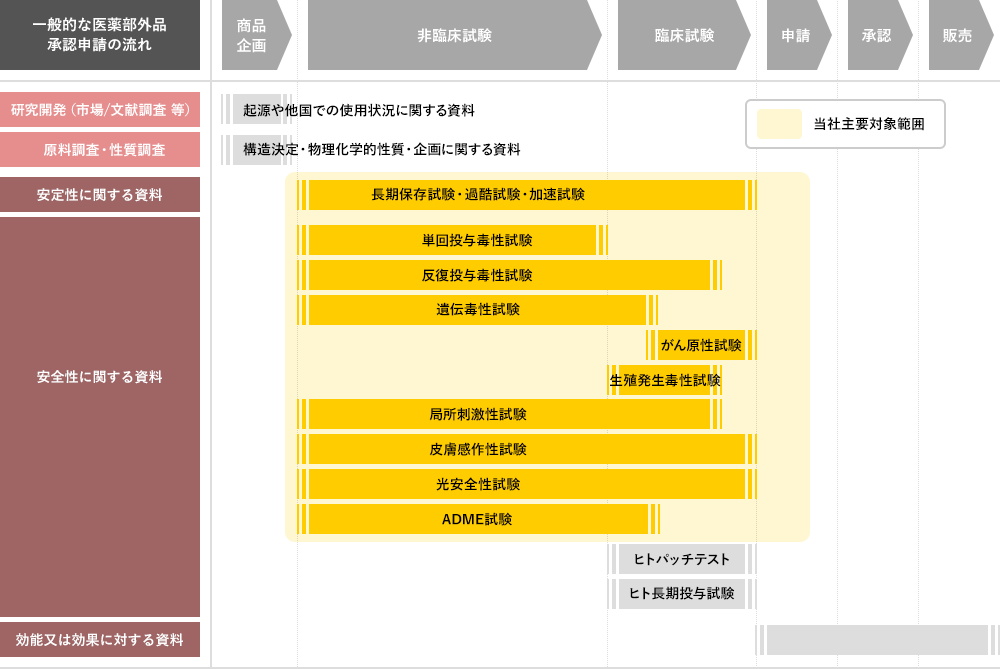
医薬部外品 安全性試験 毒性試験の受託機関 ボゾリサーチセンター

新薬の薬価はどう決まる Answersnews Plus

医薬品 Ii新薬の研究開発 承認のプロセス

医薬品 開発支援 サービス 株式会社エスアールディ Cro Srd 治験
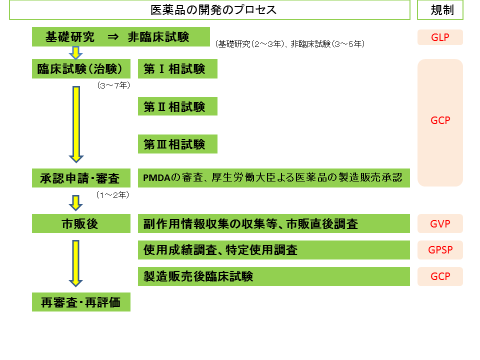
医薬品の開発プロセス 治験 発ケン 広島県 広島県
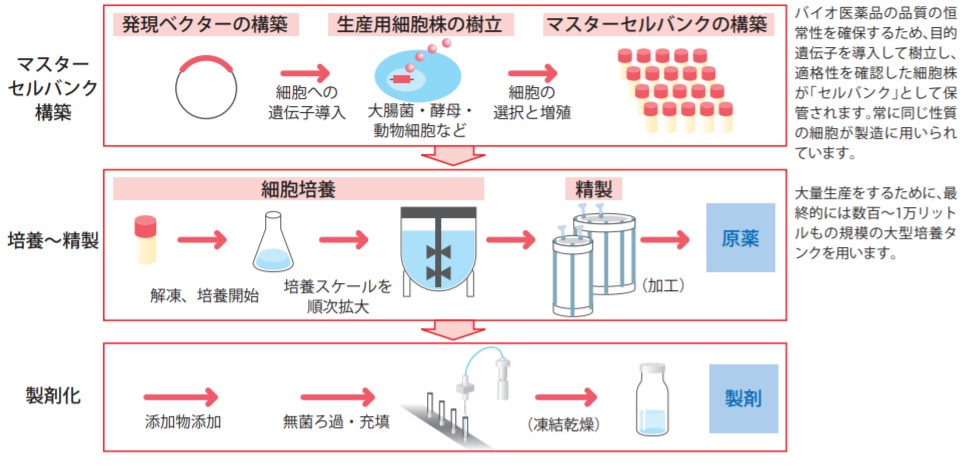
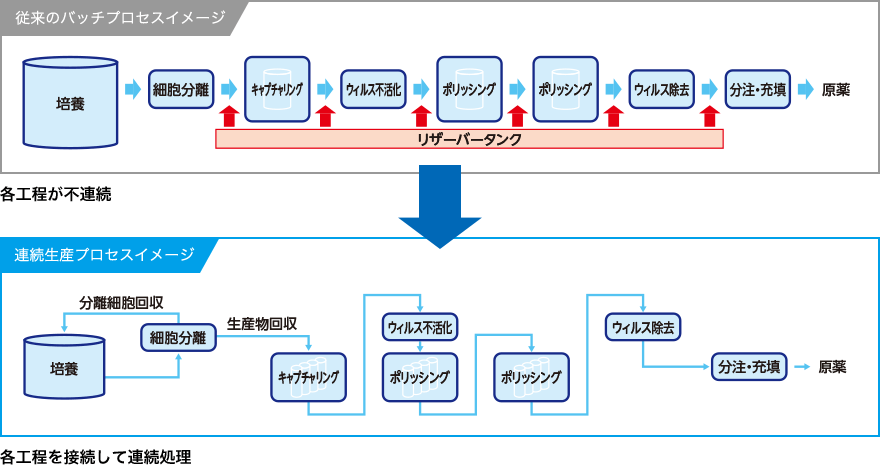
バイオ医薬品製造の流れ

原薬を取り巻く法規制 日本医薬品原薬工業会

医薬品や医療機器の臨床試験や審査 承認の現場が新しい展開を迎えている 特集記事 Nature Careers Nature Research
新薬研究開発のプロセス 研究開発 生化学工業株式会社

医薬品開発の流れ

文部科学省 次世代がん研究シーズ戦略的育成プログラム

進化を続ける製薬業界とcroの存在意義 イーピーエス株式会社採用情報

Snp バイオマーカーなどの研究開発



